ELEMENTS DE PHYSIQUE:La température,La chaleur,La puissance,La pression
1. La température
Le chaud et le froid sont appréciés par des sensations d’où une évaluation irrationnelle de
ces grandeurs.
Aussi, il a été définit la température qui permet une objectivité des mesures. La température
caractérise le niveau auquel la chaleur se trouve dans un corps permettant ainsi de dire
qu’un corps est plus ou moins chaud qu’un autre.
Les températures dans le S.I. sont exprimées en °C (degrés Celsius) mais dans la littérature,
on rencontre les degrés Fahrenheit (°F) et les degr és Kelvin (°K)
Conversion entre les différentes unités de temperatures
2. La chaleur
La chaleur est une forme d’énergie (énergie de mouvement des molécules) qui va d’un point
chaud (température plus élevée) vers un point froid (température moins élevée).
C’est la sensation perçue par nos organes de sens lorsque nous sommes placés devant un
corps incandescent par exemple.
L’unité légale est le Joule (J) mais la kCal (kiloCalorie) est également utilisée.
Une kCal est la quantité de chaleur qu’il faut fournir à un kG d’eau pour augmenter sa
température de 1°C.
Conversion d’unités :
1 kCal = 4,185 kJ = -1 Fg (frigorie)
1 thermie (Th) = 1000 kCal = 4,185 kJ
1 BTU = 1,053 kJ (BTU : British Thermal Unit)
3 La puissance
La puissance est le rapport de l’énergie fournie ou absorbée sur l’unité de temps.
L’unité légale est le Watt (W).
Conversion d’unités :
1 kW = 860 kCal/h
1 kCal/h = -1 Fg/h = 1,163 W
1 cv (cheval) = 736 W
4 La pression
L’unité légale de la pression est le Pascal (Pa) qui est égal à la pression uniforme exercée
par une force de 1 N (Newton) sur une surface de 1 m2.
L’unité de pression couramment utilisée par les frigoristes est le Bar et il faut distinguer :
Les appareils de mesure des pressions (appelés manomètres) sur les systèmes
frigorifiques qui sont gradués généralement en pression relative (par rapport à la
pression atmosphérique)
les appareils de mesures du vide (appelés vacuomètres) sur les systèmes frigorifiques
qui sont gradués en pression absolue (par rapport au vide absolu).
Conversion d’unités
1 Bar = 105 Pa = 1.02 kG/m2 = 0.986 atm = 750 mmHg
1 Bar = 14.54 PSI = 10.2 mCE (mètre de colonnes d’eau)
PSI : Pound per Square Inch (Livre par Pouce carré)
1.3.5 Le changement d’état
La maîtrise des deux états de la matière que sont la phase liquide et la phase vapeur est
primordiale en froid.
Le changement d’état se définit comme la phase de transformation d’une phase vers une
autre phase.
La figure 1.1 donne les différents changements d’état possibles de la matière.
A titre d’exemple, il sera rappelé les changements d’état pour l’eau (cf. figure 1.1) :
Ces changements sont les suivants :
le passage de l’état solide (glace) à l’état liquide, appelé la fusion
le passage de l’état liquide à l’état solide (glace), appelé la congélation (ou solidification)
le passage de l’état liquide à l’état liquide à l’état vapeur, appelé la vaporisation (ou
l’ébullition ou encore l’évaporation)
le passage de l’état vapeur à l’état liquide, appelé la liquéfaction (ou condensation)
Ainsi sont définis les termes suivants :
la chaleur latente de congélation ou chaleur latente de fusion suivant qu’on passe de la
phase liquide vers la phase solide ou vice versa ; pour l’eau cette chaleur latente est
de 334.8 kJ/kG (80 kCal/kG) à la pression atmosphérique, la température de
congélation étant de 0°C à cette pression
la chaleur latente de vaporisation ou de condensation suivant qu’on passe de la phase
liquide à la phase vapeur ou vice versa ; pour l’eau cette chaleur latente est de
2254.7 kJ/kG (539 kCal/kG) à la pression atmosphérique, la température
d’évaporation étant de 100°C à cette pression
Comme autres changements d’état, il faut citer :
la sublimation (passage de l’état solide à l’état vapeur)
la désublimation (passage de l’état vapeur à l’état solide)
En rappel, il existe pour tout corps pur, une relation pression température si et seulement si
la vapeur est contact avec le liquide qui lui a donné naissance.
A chaque corps correspond une courbe de changement d’état représenté dans le
diagramme thermodynamique pression (Log P) – enthalpie (h) appelé diagramme
enthalpique ou diagramme de Mollier des frigoristes.
Ce diagramme est utilisé pour l’étude des cycles de réfrigération.
Les autres diagrammes thermodynamiques ne sont pratiquement pas utilisés par les
frigoristes.
Le diagramme Température (T) – entropie (s) est utilisé à des fins pédagogiques ou
lorsqu’on veut concevoir un procédé (applications aux machines thermiques).
Le diagramme enthalpie (h) – entropie (s) aussi appelé diagramme de Mollier des motoristes
est utilisé pour l’étude des cycles moteurs à vapeur.
De A à B :
La température de la glace augmente régulièrement pour atteindre 0°C. La chaleur
apportée et nécessaire à cette étape est de 41,8 kJ. C'est de la chaleur sensible (la
température augmente).
En B :
On a un bloc de glace de 1kg à 0°C.
De B à C :
A 0°C, la 1ère goutte de liquide apparaît et la glace commence à fondre. Pendant toute la
fonte de la glace, le mélange liquide/solide aura une température rigoureusement égale à
0°C. La chaleur apportée est de 335 kJ, c'est de la chaleur latente (la température reste
constante).
En C :
On a 1kg d'eau entièrement liquide à 0°C.
De C à D :
La température de l'eau s'élève progressivement jusqu'à atteindre 100°C. Pour réaliser
cette augmentation de température, nous devons apporter 419 kJ. C'est de la chaleur
sensible.
En D :
On a 1kg d'eau entièrement liquide à 100°C, c'est du liquide saturé.
De D à E :
A 100°C, comme nous continuons à apporter de la chaleur, l'eau se met à bouillir et la
première molécule de vapeur apparaît. C'est le début de l'évaporation. La température
reste constante pendant tout le changement d'état. Quand la dernière goutte de liquide
s'évapore, le changement d'état sera terminé, nous aurons apporté 2257 kJ de chaleur
latente.
16
En E :
Nous avons 1kg de vapeur à 100°C, c'est de la vapeur saturée.
Après E :
Si on continue à chauffer la vapeur, la température continue d'augmenter nécessitant 1,9
kJ/kg.K.
Abonnez-vous à ma chaîne YouTube
Téléchargez l'application de ma chaîne
Mon compte site sur Facebook
par kandi younes

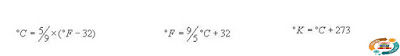








0 Commentaires